1639
kémia meg minden....
-
polarka #1479 ∫1/AB dA= -∫k dt
Ahol az első integrál határai A0=A(t0) és A(t)
A második oldalé pedig t0 és t. Viszont B A-tól nem független.
Mivel A és B meredekségei azonosak, ugyanúgy fogynak, ezért B=A+c alakba írható. Az integrál kiszámolásakor pedig majd c=B0-A0 formában is átírható.
Ekkor 1/AB = 1/(A*(A+c)) helyettesítés kell.
Innentől már parciális törtekre bontás és lehet is integrálni, h az utolsó sorodban felírt egyenletet kapjad. -
 #1478
#1478
eh hülye vagyok bocsi az természetesen dt, nem d[ T] -
 #1477
#1477
így értettem:
-
 #1476
#1476
Valaki nem tudja, hogy egy A+B->T típusú reakció sebességét leíró differenciális egyenletét, ami r=-d[A]/dt=k[A][B], hogy lehet integrális formává alakítani? ([]:koncentrációk, k:sebességi együttható)
Elvileg egy elég csúnya kifejezés jön ki:
1/([B]°-[A]°)*ln(([B][A]°)/([A][B]°))=kt , ahol []°:kiindulási koncentrációk -
 #1475
#1475
ha egy kicsit pontosabban letudnád írni, mert így fogalmam sincs mik ezek a betűk -
barcames #1474 köszönöm!
-sorolja fel a képletben használt paraméterek (KOI,a,b,f,c) jelentését. KOI= (a - b) x f x 80/ c
ebben a kérdésben tudnál segíteni? mert ezt nem értem:( -
 #1473
#1473
mert valami akkor vezeti az áramot, ha vannak benne mobilis töltéssel rendelkező részecskék (pl. elektronok fémben, vagy ionok folyadékban)
A deszt. víz csak nagyon kevés iont tartalmaz, ha a tiszta vizet vesszük, akkor abban ugyebár szobahőfokon OH- és H+ ionok vannak az autoprotolízis miatt.
Ezeknek a koncentrációja pedig alacsony, szobahőmérsékleten: [OH-]=[H+]=10^(-7) M -
barcames #1472 valaki elírná nekem, hogy a desztillált víz miért rossz vezető? -
 #1471
#1471
háhááá, megvan a 3.ZH :D neki is állok atomizálni a vegymű jegyzetet XDD -
 #1470
#1470
hát, pontosabban fogalmazva a feladat nem az volt h ezt kiszámold, ha jól emlékszem hőátbocsátást kellet számolni, csak ahhoz kell a gőz hőmérséklete, ami így volt megadva.
A mostani ZH más volt :D
Amúgy szerintem nem befolyásolja a kondenzációs hőmérsékletet, ha párát tartalmaz, csak az entalpiája lesz kevesebb, így szerintem csak simán az 1.8 bar-nál kell kikeresni.
de vegyipari műveletek nem igazán az én kenyerem :D, most várom a 3. ZH eredményeit .... jövőre meg labor :D -
polarka #1469 És elárulod hogyan lehet megtudni egy 5% páratartalmú 1,8bar nyomású gőz hőmérsékletét a táblázat alapján? :x
Hátha mi is tanulunk belőle vmit :) -
 #1468
#1468
arról szól :)
közben megírtam 75%osra, ú.h. ment :P
azért köszi -
polarka #1467 hát a jegyzetek nem túl bőbeszédűek :)
Ez arról szól, h a telített gőzben is van kis mennyiségű kondenzált folyadék? Az i' meg i''-re meg nincsen tippem. -
polarka #1466 Forráspont-emelkedés törvénye
Anno még Általános kémiában is volt, vagy itt már nem híg oldatok esetével kell számolni?
Clausius-Clapeyron-t és a Raoult-tv.-t kell összegyűrni egy feltevéssel.
Forráspont kell meg párolgási entalpia. -
polarka #1465 google első néhány találta közt volt KOI link
A kérdéseidre benne vannak a válaszok. -
dopli #1464 Hali! A kedvenc fizkémtanárom a következő feladatot adta fel: Számold ki a ciklohexán ebullioszkópos állandóját! (A szükséges adatoknak nézz utána!)
Annyit tudok, hogy ez magyarul moláris forráspont növekedést jelent, de hát mégis honnan nézzek utána és milyen adatoknak?
pls help -
 #1463
#1463
Lenne egy kérdésem vegyipari műveletek témakörben.
Volt egy feladat ZH-n, aminek egy részében ki kellett számolni egy lekondenzáló gőz hőmérsékletét.
A gőz nyomása 1.8 bar, nedvességtartalma 5%.
A következő táblázat állt a rendelkezésre:
Táblázatok -
barcames #1462 nem, órára kell és amit nem találok meg nem tudom kidolgozni azt ide beírom. -
polarka #1461 zsír 
-
polarka #1460 ezeket nem neked kéne megválaszold a kapott jegyzet alapján? -
barcames #1459 -milyen közegbe játszódik le a KOI meghatározás? ezt a közeget hogyan állítottuk elő?
-az oxálsav mivé alakul a KOI meghatározásánál reakció végére?
- az oldószer mivé alakul a reakció végére a KOI meghatározásakor? ezt milyen színváltozás követi?
-
barcames #1458 köszönöm! -
 #1457
#1457
meg persze az utolsó előtti sem (: -
 #1456
#1456
az utolsó szerintem sem megy semerre -
pet0330 #1455 Bocs amikortól vastag oda az egyenlőségjel elé [ b_] volt írva.
Amugy máshogy is lehet magyarázni, az sokkal megfoghatóbb, ez egy dinamikus egyensúly, tehát a reakció egyszerre megy mindkét irányba és így beállt ez az egyensúly: TFH: CO és H2O ütközik, akkor végbemegy jobbra, ha CO2 és H2 ütközik akkor végbemegy balra, na most ha kiveszed a CO-kat, akkor az elsőfajta ütközésből kevesebb lesz, de a 2. fajta ütközések száma állandó marad( picit nő mert nő a koncentráció) tehát balrafelé nagyobb lesz a sebesség mint jobbra, tehát balra fog a reakció eltolódni)
(Ez az egész csak olyan körülmények között működik, ahol ezek a reakciók végbemennek) -
pet0330 #1454 Jó akkor csak szerintem nem megy semmerre az uolsó kettőnél, mivel az már korábbanleírt elv alapján a semmelyik irány nem tudja csökkenteni a hatást ami létrehozta.(ez a nyomásosra)A katalizátor pedig csak mindkét irányú reakciót meggyorsítja, tehát gyorsabban áll be az egyensúlyi állapot, de az állandó nem változik.
Na a c-re: ([b]=a b anyag koncentrációja) Fel tudsz írni a reakcióra egy egyensúlyi állandót ha nem változtatgatod a dolgokat akkor ez állandó. K=[CO2]*[H2]/([CO]*[H2O])Na most ha elkezded kivenni a CO-t akkor hogy ez állandó maradjon akkor nőnie kell a [H2O]-nak és ezáltal csökkennie a [CO2]*[H2]-nek, tehát a reakció a víz keletkezése felé kell eltolódnia. -
 #1453
#1453
Hehhe, ez nem fog menni. :D
Az utolsó kettőnél nem értem, hogy miért nincs semmi, mert eddi nem volt olyan példa, hogy semerre, de hiszek neked.
A c)-nél el tudod magyarázni, hogy miért? -
Berselius #1452 Ox. számok:
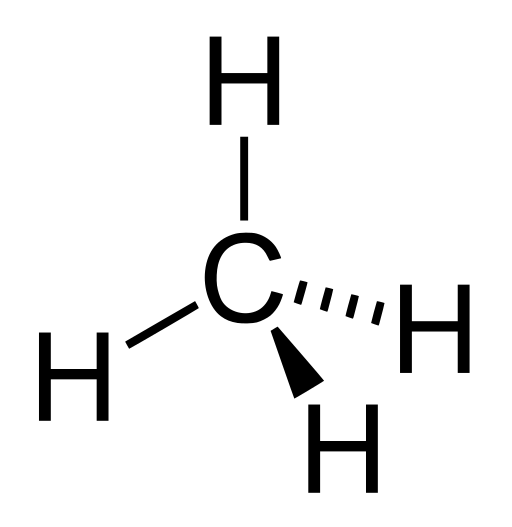
Kovalens vegyületek esetén: Először felrajzoljuk a képletét, legyen a példa a metán:
Vizsgáljuk az egyes elemek elektronegativitását! A hidrogéné 2,1, míg a széné 2,5. Ezek alapján -mivel a szénnek nagyobb az elektronvonzó képessége- a szén kap egy (-4)-szeres töltést, míg a hidrogén (+1)-est (a kötések polaritása miatt). Ezek csak parciális töltések, tehát nem úgy kell értelmezni a molekulát mintha egy C4- és négy darab H+ ionból állna, mivel ezek sokkal kisebb töltések. Ezek alapján tehát a metánban a szén ox. száma -4, a hidrogéneké +1.
Egyszerű ionok: Az ox. szám a töltésszámmal egyezik meg, tehát pl. S2- ox. száma -2, vagy Ca2+ ox. száma +2.
Összetett ionok: Azt tudni kell, hogy az összetett ionok töltése megegyezik a bennük lévő anyagok ox. számainak összegével. További fontos tudnivalók:
- Oxigén ox. száma ált. -2, kivétel: peroxidok (-1) és szuperoxidok (-0,5) valamint a fluor-oxid (F2O, itt +2)
- A fluor ox. száma mindig -1
- A hidrogén ox. száma ált. +1, kivétel a sószerű (ionos) hidridek (pl. NaH), itt -1
Ezek alapján pl. nitrátionban (NO3-) mivel az oxigén ált. -2, és ez nem kivétel, ezért ennek az ox. száma (-2), mivel 3 van belőle ezért -6. Ahhoz, hogy -5 legyen az összeg a nitrogéné +5 kell, hogy legyen.
Talaj redoxipotenciálja: Ha a red-oxi potenciál érdekel azt leírhatom, hogy a talajnak mennyi azt nem tudom, gondolom függ az összetételétől.
Elektronvezetők: hát nem tudom mire gondolsz, elvileg az elektromos áram is elektronokból áll, tehát az elektromos vezetők környékén érdemes keresgélni. -
pet0330 #1451 Pl.: CO(g)+H2O(g) (oda-vissza nyíl) CO2(g)+H2(g)
A jók:
a)növeljük a víz koncentrációját-->jobbra
b)melegítjük a gázlegyet-->endo
c)megkötjük a CO-t-->balra
d)katalizátort alkalmazunk-Sehova(csak gyorsít)
e)növeljük a nyomást-->Semerre (jobb és baloldal anyagmennyiségre ugyan annyi és minden gáz)
-
 #1450
#1450
Akkor végül is melyik jó, melyik rossz? -
 #1449
#1449
Igen, csak oda kell írni, hogy merre megy a reakció ezektől a hatásoktól. :) -
 #1448
#1448
jaha, ezek szerint te írtad oda, hogy "-->exo"/"-->endo"
mert azt nem tudtam értelmezni.
Nem tudom pontosan mire gondoltál, amúgy van egy exoterm irány, meg egy endoterm irány, de kapásból nem tudom biztosra megmondani h melyik-melyik irány. Ki lehet számolni ha nincs megadva a molekulák standard képződéshőjéből a reakcióhőt, de ehhez is lusta vagyok most :D
én vhogy így írnám:
a)balra tolódik el
b)endotherm irányba tolódik
stb. -
 #1447
#1447
Tehát a feladatom amit leírtam teljesen rossz? :D
Csak, mert nem vagyok benne biztos, hogy értem.
Egyébként köszönöm. :) -
 #1446
#1446
így van, a reakciót néha a diák tolja el XD -
#1445
A katalizátor pedig nem tolja el a reakciót, csupán hamarabb éri el a rendszer az egyensúlyt -
 #1444
#1444
Le Chatelier elv: egyensúlyban lévő rendszer külső zavarásra úgy reagál, hogy a zavarás hatásait csökkentse.
tehát vha van egy reakciód ami egyensúlyban van és t.f.h. balról jobbra exotherm (hő keletkezik), akkor ha kívülről elkezdjük melegíteni a rendszert, az egyensúly balra fog eltolódni, hogy a "zavarást csökkentse", ha jobbra tolódna el, akkor még több hő keletkezne, ez ellentmondana az L. C.-elvnek.
Így pl. ha növeljük a nyomást, egy egyensúlyban lévő reakció abban az irányba tolódik el, amelyikben kevesebb molekula keletkezik, mert kevesebb molekula alacsonyabb nyomást jelent. -
 #1443
#1443
Sziasztok!
Kémiai egyensúly változása külső hatásokra (höm., konc., nyom.) valaki el tudná magyarázni valami hihetetlen egyszerű módon?
Milyen irányú változások történnek az alábbi egyensúlyi rendszerben, ha
Pl.: CO(g)+H2O(g) (oda-vissza nyíl) CO2(g)+H2(g)
a)növeljük a víz koncentrációját-->exo?
b)melegítjük a gázlegyet-->endo?
c)megkötjük a CO-t-->exo?
d)katalizátort alkalmazunk--exo?
e)növeljük a nyomást-->exo?
Köszönöm a segítséget! -
barcames #1442 hogyan határozzuk meg az egyes elemek oxidációs számát:
- kovalens kötésű vegyületekben?
- egyszerű ionok esetén?
- összetett ionok esetén?
- mit mutat meg egy talaj mérhető redoxi potenciálja?
-mik az elektronvezetők?hogyan változik a vezetőképességük?
Köszönöm előre is! -
barcames #1441 köszönöm! -
Berselius #1440 pH mérés: a klasszikus módja az indikátorok használata, ezek bizonyos pH-tartományok között megváltoztatják a színűket. A legjobb ilyen szempontból az univerzál indikátor, ami minden pH-értéket jelez. Egy újabb mérési mód az elektromos műszer, ennek működését sajnos nem ismerem.
Gerjesztett állapot: Az atomon belül az elektronok az atommag körül keringenek. A Heisenberg-féle határozatlansági reláció miatt azonban nem tudjuk pontosan megmondani a helyét, tehát azt szokták mondani hogy az atompálya (tehát az elektron pályája) az a térrész az atomon belül, ahol az elektron 90%-os valószínűséggel van jelen. Ha az atommal energiát közlünk, akkor az elektronok ebből a térrészből kimozdulhatnak, ekkor beszélünk gerjesztett állapotról.
pH skála: A pH skálát általában 0-tól 14-ig szokták megrajzolni, ezen 0-tól 7-ig található a savas kémhatás, a 7-es pH a semleges és 7-14 a lúgos/bázikus.