Hunter
Lézer vesesejtekből
Először sikerült egy biológiai sejtből lézert alkotni. A szokatlan megoldáshoz emberi vesesejtet alkalmaztak. Az ilyen "élő lézerek" az élő szervezetben teljesíthetnek a jövőben szolgálatot, lehetővé téve belső szöveteink páratlan pontosságú leképezését.
Hogyan érhető el egy élő sejtnél egy ilyen bizarr képesség? Egy lézer jellemzően egy erősítő közegből, a fény felerősítését szerkezeti tulajdonságaiból adódóan lehetővé tevő anyagból, és a két oldalán elhelyezkedő tükrökből tevődik össze. Egy energiaforrás, például egy villanófény, vagy egy elektromos kisülés gerjeszti az erősítő közeg atomjait, fotonokat szabadítva fel. Normál esetben ezek véletlenszerű irányokba lövellnek ki, amint egy zseblámpa fénycsóvája, a tükrök azonban egy irányított sugarat eredményeznek. A fotonok oda-vissza pattogva a tükrök között, újra és újra áthaladva az erősítő közegen további, velük azonos hullámhosszú, fázisú és irányú fotonok kibocsátását indukálják. Végül egy koncentrált, egyfrekvenciás fénysugár lép ki az egyik tükrön keresztül, ezt nevezzük lézerfénynek.
Számos lézer létezik, melyek több száz különböző erősítő közeget alkalmaznak, köztük festékeket és gázokat, eddig azonban még senki sem próbálkozott élő szövettel. Malte Gather és Seok-Hyun Yun a Harvard Egyetemen főként kíváncsiságból határozta el, hogy egy emlős sejtjével megvizsgálja a lehetőséget.
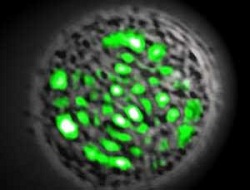 Választásuk az emberi vesesejtre esett, amibe egy zöld fluoreszcens proteint (GFP) kódoló DNS-hurkot injektáltak. Utóbbit egy medúzából izolálták, ami kék fénynek kitéve zölden fluoreszkál, és már korábban is rendkívül értékes biológiai jelzőnek bizonyult, segítségével ugyanis nyomon követhetők a sejtekben a molekulák útvonalai és felragyog, ha adott gének kifejeződésre kerülnek. A két tükör közé helyezett sejtet a kutatók kék fény impulzusokkal kezdték bombázni, míg el nem kezdett fluoreszkálni. Ahogy a zöld fény a tükrök között pattogott, egyes hullámhosszok felerősödtek, egészen addig, míg lézerfényként át nem törtek az áttetsző tükrökön. A sejt több percnyi lézerként működés után is életben volt, és ellátta funkcióját.
Választásuk az emberi vesesejtre esett, amibe egy zöld fluoreszcens proteint (GFP) kódoló DNS-hurkot injektáltak. Utóbbit egy medúzából izolálták, ami kék fénynek kitéve zölden fluoreszkál, és már korábban is rendkívül értékes biológiai jelzőnek bizonyult, segítségével ugyanis nyomon követhetők a sejtekben a molekulák útvonalai és felragyog, ha adott gének kifejeződésre kerülnek. A két tükör közé helyezett sejtet a kutatók kék fény impulzusokkal kezdték bombázni, míg el nem kezdett fluoreszkálni. Ahogy a zöld fény a tükrök között pattogott, egyes hullámhosszok felerősödtek, egészen addig, míg lézerfényként át nem törtek az áttetsző tükrökön. A sejt több percnyi lézerként működés után is életben volt, és ellátta funkcióját.
"A GFP hasonló a kereskedelmi festéklézerekhez alkalmazott festékekhez, így nem meglepő, hogy ha egy sejtbe ültetjük és optikailag felpumpáljuk, akkor egy lézert kapunk. A tény azonban, hogy bizonyították a működését, nagyon tetszik" - kommentálta az eredményeket Christopher Fang-Yen, a Pennsylvania Egyetem munkatársa, aki maga is egyatomos lézereken dolgozik, a Harvard kutatásában azonban nem vett részt. Yun is csupán azt szeretné letesztelni, hogy lehetséges-e egy biológiai lézer, de természetesen több potenciális alkalmazás is ott motoszkál a fejében. "Szeretnénk egy lézert bejuttatni egy állat testébe, lézerfényt generálva közvetlenül a szöveteiben" - tette hozzá.
A lézer optikás tomográfia elnevezésű eljárásban lézersugarakat lőnek a testen kívülről az élő szövetekre, terjedésével és szóródásával felfedve méretét, térfogatát és mélységét, képet alkotva a szövetekről. Ha mindezt a testen belülről indukálhatnák, az sokkal részletesebb képeket eredményezne. Egy másik technika, a fluoreszcens mikroszkópia a GFP-vel felturbózott élő sejtek ragyogásán alapul, aminek a felbontásán ugyancsak sokat javíthatna Yun biológiai lézere.
Ahhoz, hogy egy élőlény sejtjeit lézerekké változtassák, úgy kell módosítani, hogy azok GFP-t fejezzenek ki. Yun lézerének tükreit nanoméretű fémdarabok testesítenék meg, melyek fénygyűjtő antennákként viselkednének. "Korábban a lézerre egy mérnöki anyagként tekintettünk és most bebizonyítottuk, hogy a lézer koncepciója biológiai rendszerekbe is beültethető" - összegzett Yun.
Hogyan érhető el egy élő sejtnél egy ilyen bizarr képesség? Egy lézer jellemzően egy erősítő közegből, a fény felerősítését szerkezeti tulajdonságaiból adódóan lehetővé tevő anyagból, és a két oldalán elhelyezkedő tükrökből tevődik össze. Egy energiaforrás, például egy villanófény, vagy egy elektromos kisülés gerjeszti az erősítő közeg atomjait, fotonokat szabadítva fel. Normál esetben ezek véletlenszerű irányokba lövellnek ki, amint egy zseblámpa fénycsóvája, a tükrök azonban egy irányított sugarat eredményeznek. A fotonok oda-vissza pattogva a tükrök között, újra és újra áthaladva az erősítő közegen további, velük azonos hullámhosszú, fázisú és irányú fotonok kibocsátását indukálják. Végül egy koncentrált, egyfrekvenciás fénysugár lép ki az egyik tükrön keresztül, ezt nevezzük lézerfénynek.
Számos lézer létezik, melyek több száz különböző erősítő közeget alkalmaznak, köztük festékeket és gázokat, eddig azonban még senki sem próbálkozott élő szövettel. Malte Gather és Seok-Hyun Yun a Harvard Egyetemen főként kíváncsiságból határozta el, hogy egy emlős sejtjével megvizsgálja a lehetőséget.
 Választásuk az emberi vesesejtre esett, amibe egy zöld fluoreszcens proteint (GFP) kódoló DNS-hurkot injektáltak. Utóbbit egy medúzából izolálták, ami kék fénynek kitéve zölden fluoreszkál, és már korábban is rendkívül értékes biológiai jelzőnek bizonyult, segítségével ugyanis nyomon követhetők a sejtekben a molekulák útvonalai és felragyog, ha adott gének kifejeződésre kerülnek. A két tükör közé helyezett sejtet a kutatók kék fény impulzusokkal kezdték bombázni, míg el nem kezdett fluoreszkálni. Ahogy a zöld fény a tükrök között pattogott, egyes hullámhosszok felerősödtek, egészen addig, míg lézerfényként át nem törtek az áttetsző tükrökön. A sejt több percnyi lézerként működés után is életben volt, és ellátta funkcióját.
Választásuk az emberi vesesejtre esett, amibe egy zöld fluoreszcens proteint (GFP) kódoló DNS-hurkot injektáltak. Utóbbit egy medúzából izolálták, ami kék fénynek kitéve zölden fluoreszkál, és már korábban is rendkívül értékes biológiai jelzőnek bizonyult, segítségével ugyanis nyomon követhetők a sejtekben a molekulák útvonalai és felragyog, ha adott gének kifejeződésre kerülnek. A két tükör közé helyezett sejtet a kutatók kék fény impulzusokkal kezdték bombázni, míg el nem kezdett fluoreszkálni. Ahogy a zöld fény a tükrök között pattogott, egyes hullámhosszok felerősödtek, egészen addig, míg lézerfényként át nem törtek az áttetsző tükrökön. A sejt több percnyi lézerként működés után is életben volt, és ellátta funkcióját."A GFP hasonló a kereskedelmi festéklézerekhez alkalmazott festékekhez, így nem meglepő, hogy ha egy sejtbe ültetjük és optikailag felpumpáljuk, akkor egy lézert kapunk. A tény azonban, hogy bizonyították a működését, nagyon tetszik" - kommentálta az eredményeket Christopher Fang-Yen, a Pennsylvania Egyetem munkatársa, aki maga is egyatomos lézereken dolgozik, a Harvard kutatásában azonban nem vett részt. Yun is csupán azt szeretné letesztelni, hogy lehetséges-e egy biológiai lézer, de természetesen több potenciális alkalmazás is ott motoszkál a fejében. "Szeretnénk egy lézert bejuttatni egy állat testébe, lézerfényt generálva közvetlenül a szöveteiben" - tette hozzá.
A lézer optikás tomográfia elnevezésű eljárásban lézersugarakat lőnek a testen kívülről az élő szövetekre, terjedésével és szóródásával felfedve méretét, térfogatát és mélységét, képet alkotva a szövetekről. Ha mindezt a testen belülről indukálhatnák, az sokkal részletesebb képeket eredményezne. Egy másik technika, a fluoreszcens mikroszkópia a GFP-vel felturbózott élő sejtek ragyogásán alapul, aminek a felbontásán ugyancsak sokat javíthatna Yun biológiai lézere.
Ahhoz, hogy egy élőlény sejtjeit lézerekké változtassák, úgy kell módosítani, hogy azok GFP-t fejezzenek ki. Yun lézerének tükreit nanoméretű fémdarabok testesítenék meg, melyek fénygyűjtő antennákként viselkednének. "Korábban a lézerre egy mérnöki anyagként tekintettünk és most bebizonyítottuk, hogy a lézer koncepciója biológiai rendszerekbe is beültethető" - összegzett Yun.