kémia meg minden....
-
 #996
#996
Ahogy ígértem, megtartom a bemutatót;
A prop-1-én és H-Cl elektrofil addíciója
Először vegyük szemügyre a két molekula szerkezetét, és közben elmagyarázom a kifejezéseket is.
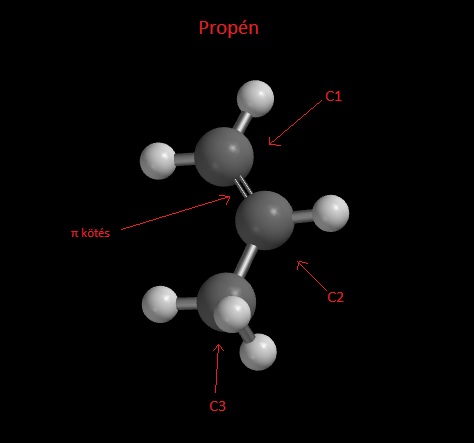
A prop-1-én, vagy propén az alkének közé tartozik (olefin), ez ugy-e azt jelenti, hogy a közönséges alkánok σ (szigma) kötéseihez képest π (pi) kötést is tartalmaz.
A prop-1-én, ahogy a nevében is szerepel, 1 π-kötést tartalmaz a C1 és C2 között, ha a C2 és C3 között lenne, az ugyanaz a molekula lenne, ezért el is lehet hagyni a prop-1-én ből az 1-est, ami a π-kötés helyét jelöli.
Amint tudjuk a π-kötés többek között abban különbözik a σ-kötéstől, hogy, nem a szóban forgó atomok között a legnagyobb az elektronsűrűség, hanem a π-kötés elektronjai a két atomot összekötő képzeletbeli sík alatt és felett tartózkodnak.
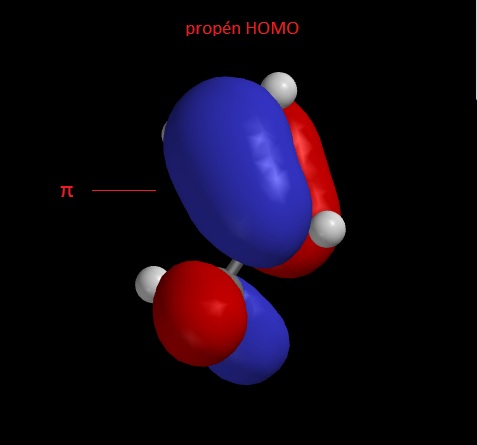
A képen bejelöltem a π-kötés helyét, jól látszik a két lebeny; azért különböző színűek, mert az őket leíró hullámfüggvény különböző előjelű; a hullámfüggvény a csomósíknál mindig előjelt vállt, és a π-kötésnek a két atomot képzeletben összekötő síkban, csomósíkja van, ez növeli a kötésben szereplő elektronok energiáját.
HOMO-nak (Highest Occupied Molecular Orbit) nevezzük azt a molekulapályát (MO), amelyen alap állapotban a legmagasabb energiájú elektronok vannak, ezután jön a LUMO (Lowest Unoccupied Molecular Orbit), itt alapállapotban nincs elektron, de ha gerjsztjük a HOMO elektronokat, akkor azok a LUMOra fognak kerülni, valamint a molekula ha egy reakcióban elektronokat kap, akkor azok szintén a LUMOra kerülnek.
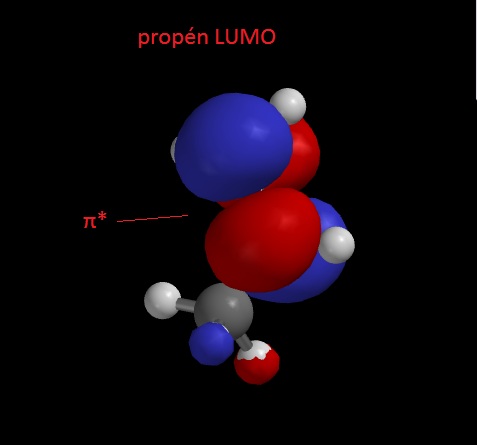
A képen bejelöltem a π pályához tartozó LUMOt (π*), ezt egyébként lazító-pályának is hívják, ezért csillagozzák, a nem lazító pályák a kötő pályák, pl a π MO.
Jól látható, hogy a π*-nak még egy csomósíkja van, ami az előző csomósíkjára merőleges. Ez azért fontos, mert ha elektronok kerülnek erre az MO-ra, akkor azok nem fogják a kötést erősíteni, hiszen a két C atomtól elkülönítve fognak tartózkodni és nem a két atom körül, ahogy a π-kötés esetében. Ezért ha a π*-ra kerülnek elektronok, megbomlik a π-kötés.
Ezen a képen az látható, hogy a π-kötés körül a legnagyobb az elektronsűrűség (kék->piros fele nő az elektronsűrűség), ami a fentiek alapján várható is volt, tehát ez a molekula legelektronegatívabb régiója, tehát egy pozitív töltésű szpéciesz itt támadna, hiszen itt a legnagyobb a Culomb-kölcsönhatás. A pozitívan töltött (parciálisan vagy teljesen) szpécieszeket a szerves kémiában általában elektrofileknek (pl proton) hívjuk, ők a negatívat kedvelik, a negatívan töltött (parciálisan vagy teljesen) szpécieszek (pl π-kötés, vagy klorid-ion) pedig általában a nukleofilek.
A HCl, amint tudjuk, nagyon poláros molekula, a Cl nagy és a H kis elektronegativitása miatt, ez a különbség az elektronsűrűség térképen is jól látszik, a Cl körül jóval nagyobb az elektronsűrűség.
Így már minden adott és érthető az alábbi reakcióhoz:
Első lépésben létezik a propén és a HCl disszociációjábol adódó H+ ás Cl-.
Amint az előbb megjegyeztük a H+ egy elektrofil, tehát betámad a propén π kötésére, amelynek a 2 elektronja így az új C-H σ-kötésbe kerülnek, hátrahagyva egy pozitív töltésű C atomot (karbokation), amely így elektrofil, és őt megtámadja a negatív töltésű klorid ion (nukleofil), megosztva vele a σ-kötéshez szükséges két elektront.
A C-H kötés viszont két helyen is kialakulhat: a C1-en és a C2-ön és ez azt jelentené, hogy kétféle termékünk lesz a végén, hiszen a Cl- pedig két helyre támadhatna. De csak egy termékünk van, és ezt a terméket Markovnyikov terméknek is nevezzük, mert a Markovnyikov szabálynak megfelelően keletkezett.
A Markovnyikov szabály azt mondja ki, hogy a halogenid magasabb rendű szénre fog betámadni. A C1 csak elsőrendű (primer), hiszen ehhez csak 1 C kapcsolódik, a C2 viszont másodrendű (szekunder), mert hozzá két C kapcsolódik, tehát a szabály szerint a halogenid ide fog támadni és ez így is történik.
Ennek az az oka, hogy két lehetséges karbokation (C1 és C2) termodinamikai stabilitása nem azonos. A C1 karbokation sokkal magasabb energiájú szpéciesz, mint a C2 karbokation és ez azt jelenti, hogy lassabban is fog képződni!
Azért stabilabb a szekunder karbokation, mert azt a két szomszédos metil csoport az ún. +I és hiperkonjugációs effektusával stabilizálja, ez nagy vonalakban abban nyilvánul meg, hogy a metil csoport C-H σ-kötésekből elektronokat szív el a karbokation, ezzel csökkentve az energiáját.